Cagrilintide เป็นเปปไทด์สังเคราะห์ที่เลียนแบบการทำงานของอะไมลิน ซึ่งเป็นฮอร์โมนที่หลั่งจากตับอ่อนที่ควบคุมระดับน้ำตาลในเลือดและความอยากอาหารประกอบด้วยกรดอะมิโน 38 ชนิดและมีพันธะไดซัลไฟด์Cagrilintide จับกับทั้ง amylin receptors (AMYR) และ calcitonin receptor (CTR) ซึ่งเป็นตัวรับควบคู่กับโปรตีน G ที่แสดงออกในเนื้อเยื่อต่างๆ เช่น สมอง ตับอ่อน และกระดูกโดยการเปิดใช้งานตัวรับเหล่านี้ คาร์กริลินไทด์สามารถลดการบริโภคอาหาร ลดระดับน้ำตาลในเลือด และเพิ่มค่าใช้จ่ายด้านพลังงานCagrilintide ได้รับการตรวจสอบว่าสามารถรักษาโรคอ้วนได้ ซึ่งเป็นโรคทางเมตาบอลิซึมที่มีไขมันส่วนเกินในร่างกายและเพิ่มความเสี่ยงต่อโรคเบาหวาน โรคหลอดเลือดหัวใจ และมะเร็งCagrilintide แสดงให้เห็นผลลัพธ์ที่น่าหวังในการศึกษาในสัตว์ทดลองและการทดลองทางคลินิก โดยแสดงให้เห็นถึงการลดน้ำหนักอย่างมีนัยสำคัญ และการควบคุมระดับน้ำตาลในเลือดที่ดีขึ้นในผู้ป่วยโรคอ้วนที่เป็นโรคเบาหวานประเภท 2 หรือไม่ก็ได้



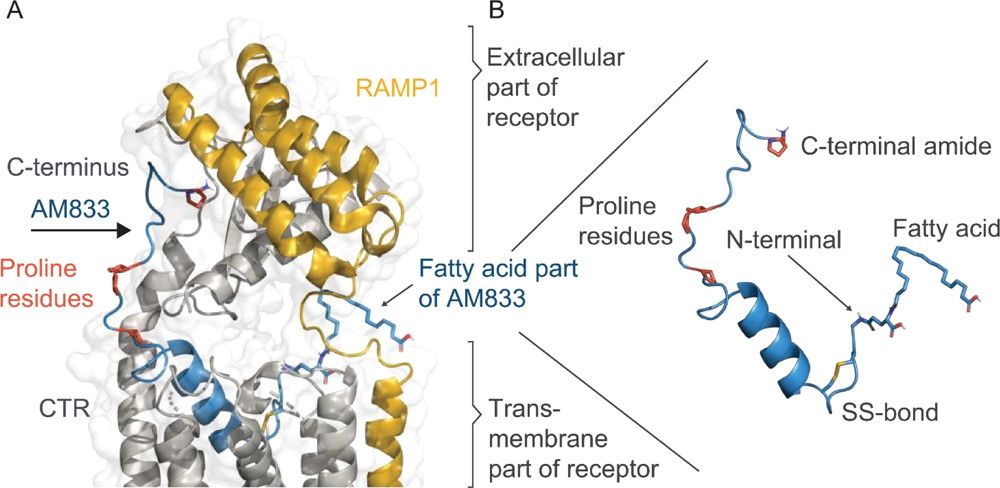
รูปที่ 1 แบบจำลองที่คล้ายคลึงกันของ Cagrilintide (23) เชื่อมโยงกับ AMY3R(A) ส่วนปลาย N ของ 23 (สีน้ำเงิน) ถูกสร้างขึ้นโดย a-helix ของแอมฟิพาทิก ซึ่งฝังลึกอยู่ในโดเมน TM ของ AMY3R ในขณะที่ส่วนปลาย C ถูกคาดการณ์ว่าจะใช้โครงสร้างเพิ่มเติมที่ผูกส่วนนอกเซลล์ของ ตัวรับ(29,30) กรดไขมันที่ติดอยู่กับปลาย N ของ 23, โพรลีนเรซิดิว (ซึ่งลดภาวะ fibrillation) และเอไมด์ที่ปลาย C (จำเป็นสำหรับการจับตัวรับ) จะถูกเน้นด้วยการแสดงแบบแท่งAMY3R ถูกสร้างขึ้นโดย CTR (สีเทา) จับกับ RAMP3 (กิจกรรมของตัวรับซึ่งปรับเปลี่ยนโปรตีน 3; สีส้ม)แบบจำลองโครงสร้างถูกสร้างขึ้นโดยใช้โครงสร้างเทมเพลตต่อไปนี้: โครงสร้างที่ซับซ้อนของ CGRP (ตัวรับคล้ายตัวรับแคลซิโทนิน; รหัส pdb 6E3Y) และโครงสร้างผลึก apo ของแกนหลัก 23 (รหัส pdb 7BG0)(B) ซูมขึ้นจาก 23 โดยเน้นที่พันธะไดซัลไฟด์ที่ปลาย N สะพานเกลือภายในระหว่างเรซิดิว 14 และ 17 “มาตรฐานลิวซีนซิปเปอร์” และพันธะไฮโดรเจนภายในระหว่างเรซิดิว 4 และ 11 (ดัดแปลงจาก Kruse T, Hansen JL, Dahl K, Schäffer L, Sensfuss U, Poulsen C, Schlein M, Hansen AMK, Jeppesen CB, Dornonville de la Cour C, Clausen TR, Johansson E, Fulle S, Skyggebjerg RB, Raun K. การพัฒนา Cagrilintide, ยาว -รักษาการ Amylin Analogue. J Med Chem. 2021 12 ส.ค.;64(15):11183-11194.)
การใช้งานทางชีวภาพของ Cagrilintide บางส่วน ได้แก่:
Cagrilintide สามารถปรับการทำงานของเซลล์ประสาทในไฮโปทาลามัส ซึ่งเป็นบริเวณสมองที่ควบคุมความอยากอาหารและสมดุลของพลังงาน (Lutz et al., 2015, Front Endocrinol (Lausanne))Cagrilintide สามารถยับยั้งการยิงของเซลล์ประสาท orexigenic ซึ่งกระตุ้นความหิว และกระตุ้นการทำงานของเซลล์ประสาท anorexigenic ซึ่งระงับความหิวตัวอย่างเช่น คากริลินไทด์สามารถลดการแสดงออกของ neuropeptide Y (NPY) และเปปไทด์ที่เกี่ยวข้องกับ agouti (AgRP) ซึ่งเป็นเปปไทด์ orexigenic ที่มีศักยภาพสองชนิด และเพิ่มการแสดงออกของ proopiomelanocortin (POMC) และโคเคนและยาบ้าที่ควบคุมโดยโคเคน (CART) สอง เปปไทด์เบื่ออาหารในนิวเคลียสคันศรของไฮโปทาลามัส (Roth et al., 2018, Physiol Behav)Cagrilintide ยังช่วยเพิ่มความอิ่มของเลปติน ซึ่งเป็นฮอร์โมนที่ส่งสัญญาณสถานะพลังงานของร่างกายเลปตินถูกหลั่งออกมาจากเนื้อเยื่อไขมันและจับกับตัวรับเลปตินในเซลล์ประสาทไฮโปทาลามัส ยับยั้งเซลล์ประสาทออริซิเจนิก และกระตุ้นเซลล์ประสาทที่เป็นโรคเบื่ออาหารCagrilintide สามารถเพิ่มความไวของตัวรับเลปตินและการกระตุ้นการทำงานของตัวแปลงสัญญาณและแอคติเวเตอร์ของการถอดรหัส 3 (STAT3) ที่เกิดจากเลปตินซึ่งเป็นปัจจัยการถอดรหัสที่เป็นสื่อกลางผลกระทบของเลปตินต่อการแสดงออกของยีน (Lutz et al., 2015, Front Endocrinol (Lausanne)) .ผลกระทบเหล่านี้สามารถลดการบริโภคอาหารและเพิ่มการใช้พลังงาน ส่งผลให้น้ำหนักลดลง
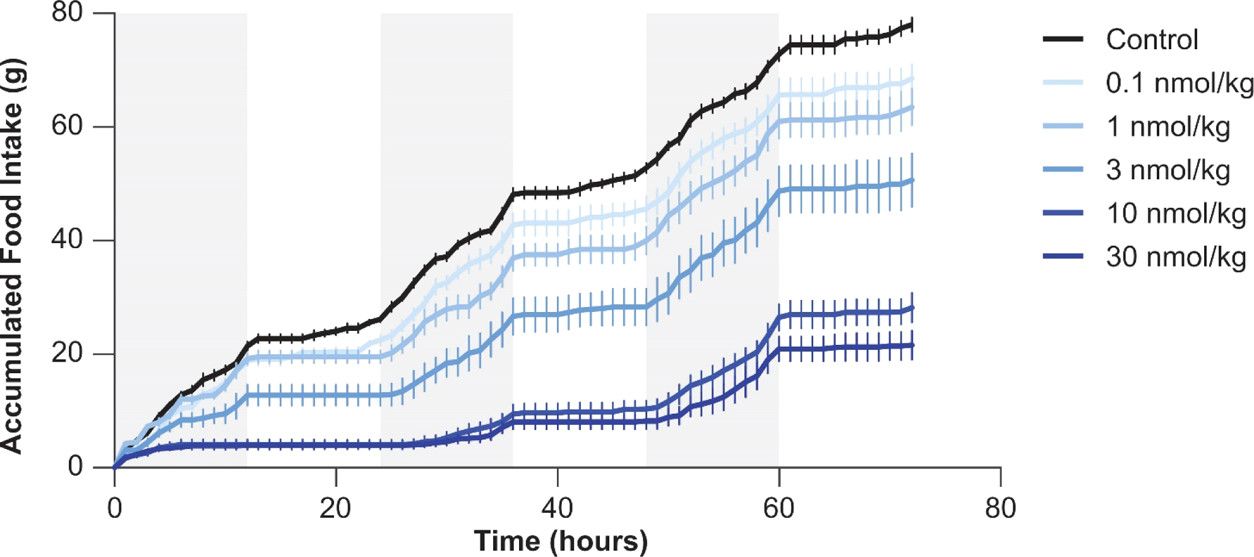
รูปที่ 2 การรับประทานอาหารในหนูหลังการฉีด Cagrilintide 23 ใต้ผิวหนัง (ดัดแปลงมาจาก Kruse T, Hansen JL, Dahl K, Schäffer L, Sensfuss U, Poulsen C, Schlein M, Hansen AMK, Jeppesen CB, Dornonville de la Cour C, Clausen TR, Johansson E, Fulle S, Skyggebjerg RB, Raun K. การพัฒนา Cagrilintide ซึ่งเป็นอะมิลินอะนาล็อกที่ออกฤทธิ์ยาวนาน J Med Chem. 2021 12 ส.ค.;64(15):11183-11194.)
Cagrilintide สามารถควบคุมการหลั่งอินซูลินและกลูคากอนซึ่งเป็นฮอร์โมนสองชนิดที่ควบคุมระดับน้ำตาลในเลือดCagrilintide สามารถยับยั้งการหลั่งกลูคากอนจากเซลล์อัลฟ่าในตับอ่อน ซึ่งช่วยป้องกันการผลิตกลูโคสมากเกินไปในตับกลูคากอนเป็นฮอร์โมนที่กระตุ้นการสลายไกลโคเจนและการสังเคราะห์กลูโคสในตับ ทำให้ระดับน้ำตาลในเลือดสูงขึ้นCagrilintide สามารถยับยั้งการหลั่งกลูคากอนได้โดยการจับกับตัวรับ amylin และตัวรับ calcitonin บนเซลล์อัลฟ่า ซึ่งควบคู่กับการยับยั้งโปรตีน G ที่ลดระดับไซคลิกอะดีโนซีนโมโนฟอสเฟต (cAMP) และการไหลเข้าของแคลเซียมCagrilintide ยังสามารถกระตุ้นการหลั่งอินซูลินจากเซลล์เบต้าในตับอ่อน ซึ่งช่วยเพิ่มการดูดซึมกลูโคสจากกล้ามเนื้อและเนื้อเยื่อไขมันอินซูลินเป็นฮอร์โมนที่ส่งเสริมการสะสมกลูโคสเป็นไกลโคเจนในตับและกล้ามเนื้อ และการเปลี่ยนกลูโคสเป็นกรดไขมันในเนื้อเยื่อไขมัน ส่งผลให้ระดับน้ำตาลในเลือดลดลงCagrilintide สามารถเพิ่มการหลั่งอินซูลินได้โดยจับกับตัวรับ amylin และตัวรับ calcitonin บนเซลล์เบต้า ซึ่งอยู่ควบคู่กับโปรตีน G ที่กระตุ้นซึ่งจะเพิ่มระดับแคมป์และการไหลเข้าของแคลเซียมผลกระทบเหล่านี้สามารถลดระดับน้ำตาลในเลือดและปรับปรุงความไวของอินซูลิน ซึ่งสามารถป้องกันหรือรักษาโรคเบาหวานประเภท 2 ได้ (Kruse et al., 2021, J Med Chem; Dehestani et al., 2021, J Obes Metab Syndr.)
Cagrilintide ยังสามารถส่งผลต่อการทำงานของเซลล์สร้างกระดูกและเซลล์สร้างกระดูกซึ่งเป็นเซลล์สองประเภทที่เกี่ยวข้องกับการสร้างกระดูกและการสลายของกระดูกเซลล์สร้างกระดูกมีหน้าที่สร้างเมทริกซ์ของกระดูกใหม่ ในขณะที่เซลล์สร้างกระดูกมีหน้าที่ทำลายเมทริกซ์ของกระดูกเก่าความสมดุลระหว่างเซลล์สร้างกระดูกและเซลล์สร้างกระดูกจะกำหนดมวลกระดูกและความแข็งแรงCagrilintide สามารถกระตุ้นการสร้างความแตกต่างและกิจกรรมเกี่ยวกับกระดูก ซึ่งจะเพิ่มการสร้างกระดูกCagrilintide สามารถจับกับตัวรับ amylin และตัวรับ calcitonin บนเซลล์สร้างกระดูก ซึ่งกระตุ้นเส้นทางการส่งสัญญาณภายในเซลล์ที่ส่งเสริมการเพิ่มจำนวนเซลล์สร้างกระดูก การอยู่รอด และการสังเคราะห์เมทริกซ์ (Cornish et al., 1996, Biochem Biophys Res Commun.)Cagrilintide ยังสามารถเพิ่มการแสดงออกของออสทีโอแคลซิน ซึ่งเป็นเครื่องหมายของการเจริญเต็มที่และการทำงานของเซลล์สร้างกระดูก (Cornish et al., 1996, Biochem Biophys Res Commun.)Cagrilintide ยังสามารถยับยั้งการสร้างความแตกต่างและกิจกรรมของกระดูกซึ่งช่วยลดการสลายของกระดูกCagrilintide สามารถจับกับตัวรับ amylin และตัวรับ calcitonin บนสารตั้งต้นของกระดูกซึ่งยับยั้งการหลอมรวมของพวกมันเป็นเซลล์สร้างกระดูกที่โตเต็มที่ (Cornish et al., 2015)คาร์กริลินไทด์ยังสามารถลดการแสดงออกของกรดฟอสฟาเตสที่ทนต่อทาร์เทรต (TRAP) ซึ่งเป็นเครื่องหมายของกิจกรรมของเซลล์สร้างกระดูกและการสลายของกระดูก (Cornish et al., 2015, Bonekey Rep.)ผลกระทบเหล่านี้สามารถปรับปรุงความหนาแน่นของมวลกระดูกและป้องกันหรือรักษาโรคกระดูกพรุน ซึ่งเป็นภาวะที่มีมวลกระดูกต่ำและเพิ่มความเสี่ยงต่อการแตกหัก (Kruse et al., 2021; Dehestani et al., 2021, J Obes Metab Syndr.)







